Definición, Estructura y Clasificación
Los aminoácidos son compuestos orgánicos fundamentales en los seres vivos, ya que constituyen las unidades básicas de las proteínas. Estos desempeñan funciones vitales en procesos metabólicos, estructurales y enzimáticos.
La estructura general de un aminoácido incluye un átomo de carbono central (carbono alfa) al que se unen cuatro grupos:
- Un grupo amino (-NH₂): componente básico que puede captar protones.
- Un grupo carboxilo (-COOH): componente ácido que puede liberar protones
- Un átomo de hidrógeno (-H).
- Una cadena lateral variable (“R”: determina las propiedades químicas y biológicas de cada aminoácido.
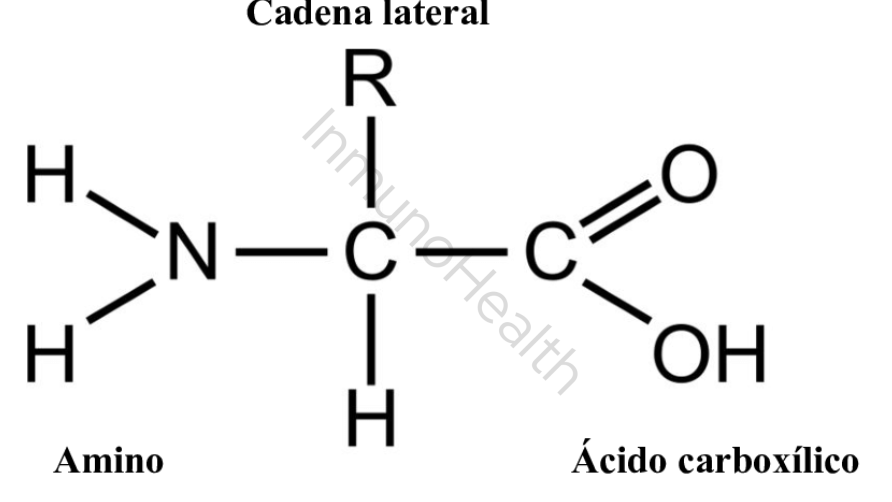
La cadena lateral R de un aminoácido es una parte clave de su estructura, ya que define la identidad y las propiedades químicas del aminoácido.
Tal y como se ha indicado anteriormente, todos los aminoácidos tienen un carbono central (carbono alfa) unido a un grupo amino (-NH2), un grupo carboxilo (-COOH), un átomo de hidrógeno y la cadena lateral R.
Es esta cadena lateral la que varía entre los 20 aminoácidos proteicos estándar, confiriendo a cada uno características únicas.
Dependiendo de la naturaleza de R, el aminoácido puede clasificarse en diferentes categorías químicas:
- Apolares o hidrofóbicos: Cadenas laterales no polares como el metilo (-CH3) de la alanina o el isopropilo de la valina, que tienden a evitar el agua.
- Polares sin carga: Cadenas laterales con grupos como -OH (serina) o -SH (cisteína), que interactúan con el agua mediante enlaces de hidrógeno.
- Ácidos: Tienen cadenas laterales con grupos carboxilo (-COOH), como el ácido glutámico, que donan protones en condiciones fisiológicas.
- Básicos: Poseen grupos amino en su cadena lateral, como la lisina, que pueden captar protones.
Estas propiedades determinan cómo interactúan los aminoácidos entre sí y con el entorno, influyendo en la estructura tridimensional de las proteínas y sus funciones.
Por ejemplo, aminoácidos hidrofóbicos suelen encontrarse en el interior de proteínas globulares, mientras que los polares se ubican en la superficie, interactuando con el medio acuoso.
Tipos de aminoácidos
En términos generales, y en base a como los obtiene el cuerpo humano, los aminoácidos se dividen en DOS tipos: aminoácidos esenciales y no esenciales
A continuación, se detalla cada tipo y sus características clave:
- Aminoácidos esenciales:
- Son aquellos que el cuerpo no puede sintetizar por sí mismo en cantidades suficientes para satisfacer sus necesidades metabólicas. Por lo tanto, es necesario incluirlos en la alimentación diaria para cubrir las necesidades nutricionales de nuestro cuerpo y mantenerlo en estado saludable.
- Hay 9 tipos de aminoácidos esenciales, que tiene las siguientes propiedades:
- Leucina: con la isoleucina, y la valina , son tres aminoácidos de cadena ramificada (BCAAs) importantes para la síntesis y reparación muscular.
- Isoleucina: síntesis y reparación muscular.
- Valina: síntesis y reparación muscular.
- Lisina: esencial para la producción de colágeno, enzimas y hormonas.
- Metionina: participa en la síntesis de proteínas y en la producción de cisteína, un aminoácido no esencial.
- Fenilalanina: precursor de neurotransmisores como dopamina, norepinefrina y epinefrina.
- Treonina: ayuda en la formación de proteínas estructurales como el colágeno y la elastina
- Triptófano: Necesario para la producción de serotonina y melatonina, regulando el estado de ánimo y el sueño.
- Histidina: importante para la producción de histamina y el mantenimiento del sistema inmune.
- Fuentes alimenticias:
- Carnes, pescado, huevos, lácteos, legumbres (como lentejas y garbanzos), frutos secos (almendras, nueces) y cereales integrales.
- Aminoácidos no esenciales:
- Son aquellos que el cuerpo puede sintetizar internamente, incluso si no están presentes en la dieta, utilizando otros compuestos metabólicos.
- Hay 11 tipos de aminoácidos no esenciales, que tiene las siguientes propiedades:
- Alanina (*): Participa en la producción de energía y ayuda a eliminar toxinas metabólicas.
- Arginina: Es esencial para la síntesis de óxido nítrico, la circulación y la eliminación de amoníaco.
- Asparagina: Facilita el funcionamiento del sistema nervioso y la síntesis de proteínas.
- Ácido aspártico: Contribuye a la producción de energía en el ciclo de Krebs.
- Ácido glutámico: Actúa como neurotransmisor excitador y en la detoxificación del amoníaco.
- Glutamina (*): Refuerza el sistema inmunológico y mantiene la salud intestinal.
- Glicina: Es clave en la formación de colágeno y la síntesis de hemoglobina.
- Prolina: Contribuye a la reparación de tejidos y la producción de colágeno.
- Serina: Participa en la síntesis de proteínas y fosfolípidos para las membranas celulares.
- Tirosina(*): Es precursora de neurotransmisores como dopamina y hormonas tiroideas.
- Cisteína(*): Es crucial para la síntesis de glutatión y la defensa antioxidante del cuerpo.
Los aminoácidos no esenciales que están marcados con un (*), son condicionalmente esenciales, lo que significa que, aunque el cuerpo puede sintetizarlos en condiciones normales, su producción puede no ser suficiente durante situaciones de estrés, enfermedad, crecimiento acelerado o traumatismos y en estos casos, deben obtenerse a través de la dieta de fuentes externas para cubrir las necesidades del organismo.
Los siguientes aminoácidos son condicionalemente esenciales en determinadas situaciones:
- Arginina: ss esencial durante el crecimiento, en situaciones de estrés severo, como infecciones o quemaduras graves.
- Glutamina: crucial durante el estrés metabólico, como enfermedades graves, lesiones o cirugía, ya que apoya el sistema inmunológico y la salud intestinal.
- Cisteína: necesaria en mayores cantidades durante el estrés oxidativo, ya que es un precursor del glutatión, un potente antioxidante.
- Tirosina: puede volverse esencial si hay deficiencia de fenilalanina, ya que el cuerpo la sintetiza a partir de este aminoácido esencial.
Enlaces peptídicos entre aminoácidos
La unión peptídica es un enlace químico esencial en la biología, ya que conecta aminoácidos individuales para formar proteínas y péptidos, las moléculas responsables de casi todas las funciones celulares.
Las uniones peptídicas se forman a través de una reacción de condensación (también conocida como síntesis por deshidratación), en la cual se elimina una molécula de agua (H₂O) durante el enlace que se forma entre dos aminoácidos, específicamente entre el grupo carboxilo (-COOH) de un aminoácido y el grupo amino (-NH₂) de otro.
Este enlace es el responsable de la formación de péptidos y proteínas, y se puede ver de forma esquemática en la figura de abajo:
- Participantes principales:
- Aminoácido 1: aporta su grupo carboxilo (-COOH).
- Aminoácido 2: aporta su grupo amino (-NH₂).
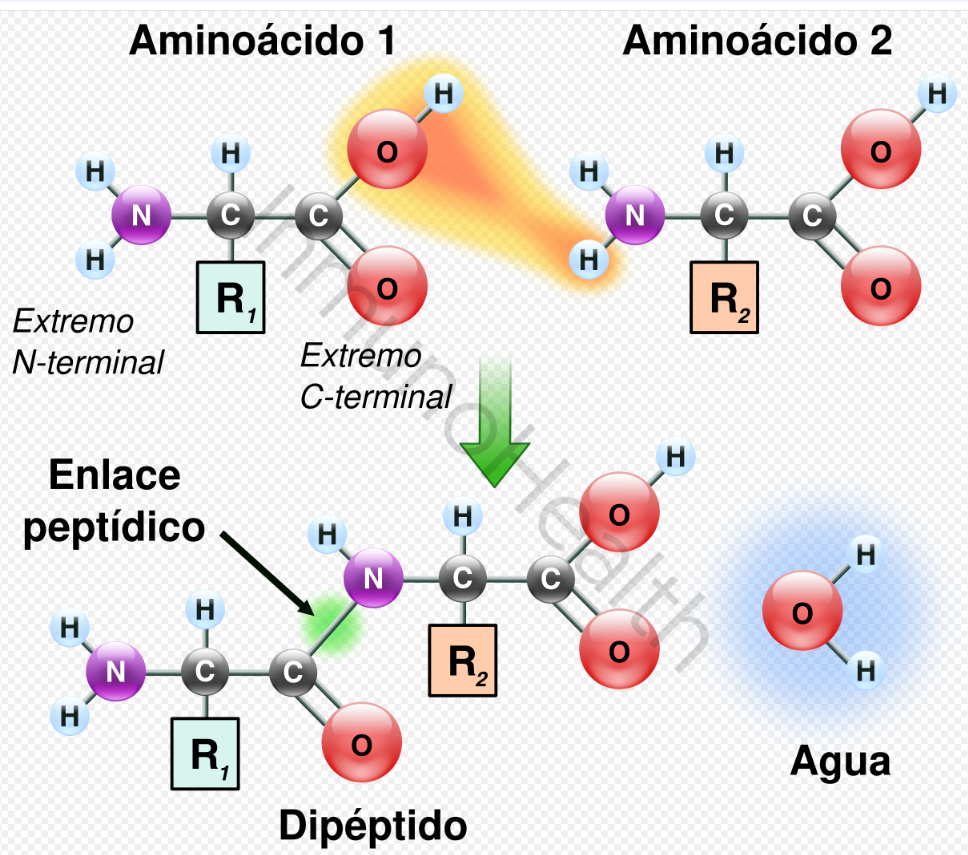
- Proceso de formación
El oxígeno y el hidrógeno del grupo carboxilo junto con un hidrógeno del grupo amino se eliminan en forma de una molécula de agua (H₂O).
Esto resulta en la formación de un enlace covalente (enlace químico que se forma cuando dos átomos comparten uno o más pares de electrones para alcanzar una configuración electrónica más estable) entre el carbono del grupo carboxilo y el nitrógeno del grupo amino (C-N), la esta cual es facilitada por enzimas específicas conocidas como ribosomas, durante la síntesis de proteínas en el proceso de traducción.
El proceso de formación del enlace covalente conocido como enlace peptídico es un mecanismo complejo que involucra varios pasos clave:
Comienza con la activación del grupo carboxilo, facilitada por enzimas o cofactores específicos, seguido de un ataque nucleofílico que genera un intermediario inestable. Posteriormente, se elimina una molécula de agua y finalmente se establece el enlace covalente C-N característico de este tipo de unión.
De esta forma se forma un dipéptido (si hay dos aminoácidos), o polipéptidos proteínas, en case de que las cadenas de aminoácidos sean más largas .
La reacción general se representa así:
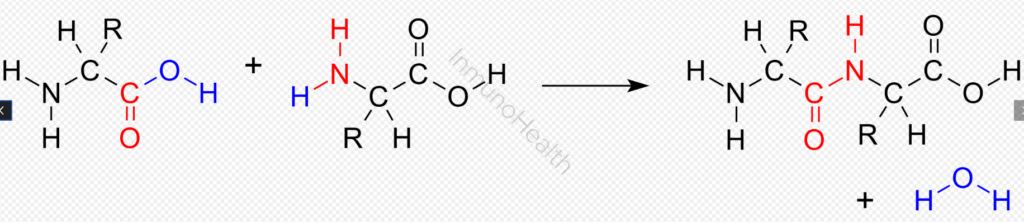
- Tipos de uniones relacionadas con los aminoácidos
- Unión peptídica:
- Formación entre aminoácidos.
- Es un enlace covalente.
- Es rígido debido al carácter parcial de doble enlace entre el C y el N.
- Puentes disulfuro (en proteínas):
- Unión entre dos moléculas de cisteína, mediante sus grupos tiol (-SH).
- Forma enlaces covalentes de azufre (S-S).
- Confiere estabilidad estructural a las proteínas.
- Interacciones no covalentes:
- Como las fuerzas de Van der Waals, interacciones hidrofóbicas y enlaces de hidrógeno. Son importantes para la estructura terciaria y cuaternaria de las proteínas.
- Unión peptídica:
- Diferencias entre las uniones
| Tipo de unión | Tipo de enlace | Función principal | Rigidez/Estabilidad |
| Unión peptídica | Covalente | Formación de cadenas polipeptídicas | Rígido |
| Puentes disulfuro | Covalente | Estabilidad estructural (enlace entre cadenas o dentro de una cadena) | Muy estable |
| Enlaces de hidrógeno | No covalente | Mantener estructura secundaria o terciaria | Moderada |
- Rol biológico de los enlaces peptídicos
- Estructura primaria de proteínas: El enlace peptídico determina la secuencia lineal de aminoácidos, conocida como estructura primaria.
- Estabilidad estructural: A través de interacciones secundarias, terciarias y cuaternarias, los enlaces peptídicos permiten que las proteínas adopten formas tridimensionales específicas.
- Función biológica: Las proteínas formadas por enlaces peptídicos desempeñan funciones enzimáticas, estructurales, de transporte, y regulación celular.
- Ruptura del enlace peptídico
La ruptura de los enlaces peptídicos es un proceso químico conocido como hidrólisis.
Este mecanismo es esencial tanto en procesos biológicos, como la digestión de proteínas, como en procedimientos químicos en laboratorios para estudiar las cadenas polipeptídicas.
Durante la digestión, las proteínas ingeridas se descomponen en aminoácidos, que luego son absorbidos y utilizados por el organismo para construir nuevas proteínas o como fuente de energía.
La hidrólisis es una reacción química en la que se utiliza una molécula de agua (H₂O) para romper un enlace covalente. En el caso de los enlaces peptídicos, la hidrólisis descompone las cadenas polipeptídicas en aminoácidos individuales o en pequeños fragmentos (péptidos).
El Proceso de Ruptura del Enlace Peptídico es el siguiente:
- Adición de Agua:
- El oxígeno del grupo carbonilo (−CO−-CO-−CO−) del enlace peptídico atrae el hidrógeno de una molécula de agua.
- Simultáneamente, el hidroxilo (−OH-OH−OH) del agua se une al nitrógeno del grupo amida (−NH−-NH-−NH−).
- Ruptura del Enlace C-N:
- Se rompe el enlace covalente entre el carbono del grupo carbonilo y el nitrógeno del grupo amida.
- Como resultado, el grupo carboxilo (−COOH-COOH−COOH) y el grupo amino (−NH2-NH₂−NH2) originales de los aminoácidos se regeneran.
- Productos Finales:
- El enlace peptídico roto genera:
- Un aminoácido con un grupo amino libre (−NH2-NH₂−NH2).
- Un aminoácido con un grupo carboxilo libre (−COOH-COOH−COOH).
- El enlace peptídico roto genera:
La ruptura de los enlaces peptídicos puede ocurrir de forma espontánea, aunque es un proceso lento bajo condiciones normales.
Sin embargo, puede acelerarse en las siguientes circunstancias:
- Condiciones Biológicas (Enzimas)
En los organismos vivos, la hidrólisis de los enlaces peptídicos es catalizada por enzimas conocidas como proteasas o peptidasas. Algunos ejemplos son:
- Tripsina: Rompe enlaces específicos en proteínas durante la digestión.
- Pepsina: Actúa en el estómago bajo condiciones ácidas.
- Quimotripsina: Hidroliza enlaces en aminoácidos específicos, como tirosina, fenilalanina y triptófano.
- Condiciones Ácidas o Básicas
- Ácido: En presencia de ácidos fuertes, como el ácido clorhídrico (HCl), la hidrólisis se acelera debido a la protonación de los grupos amida.
- Base: Las bases fuertes, como el hidróxido de sodio (NaOH), también pueden catalizar la ruptura al desprotonar el grupo carboxilo.
- Condiciones de Calor
En laboratorio, el calentamiento de proteínas en presencia de ácidos o bases puede inducir una hidrólisis completa de los enlaces peptídicos.


